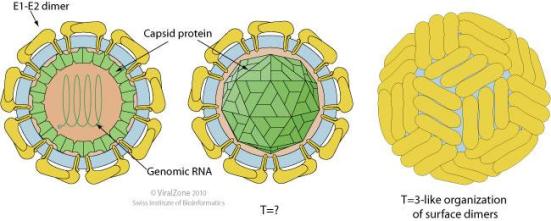
Envelope esférico de cerca de 50 nm de diâmetro. O vírus maduro contêm três proteínas da membrana codificadas (Erns, E1 e E2), além de a proteína do capsídeo.
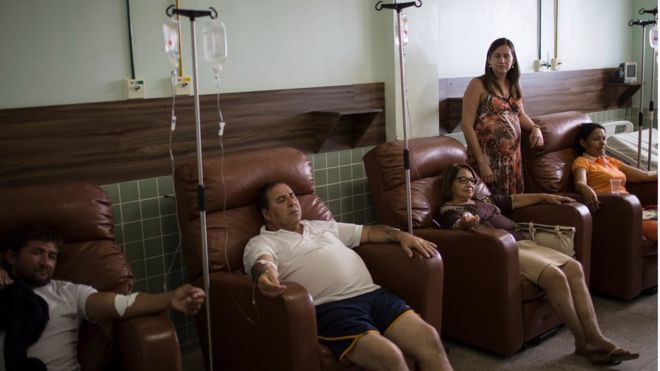
Diante do estado epidêmico que o país se encontra, é fundamental para a população compreender o significado e o potencial biológico da presença das partículas virais em grandes centros urbanos. Assim, é necessário compreender um pouco sobre a biologia básica do vírus
chikungunya. Os aspectos biológicos básicos e epidemiológicos do mosquito
Aedes aegypti(bem como do vírus da dengue) já foram descritos no texto sobre os
dados epidemiológicos da dengue. Convém uma breve leitura na qual caracteriza a taxonomia, dispersão no mosquito mundo, estratégias de contenção, além da apresentação dos dados referentes ao vírus da dengue no mundo, suas características genômicas, sua origem evolutiva e sua presença no Brasil. Aqui então trataremos primeiramente dos dados epidemiológicos do vírus chikungunya.
O vírus Chikungunya – CHIKV
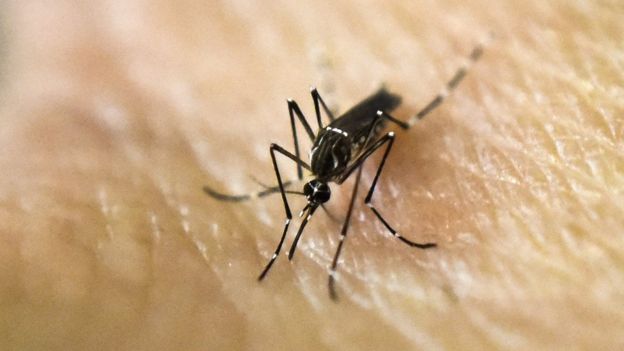
Acredita-se que a palavra “chikungunya” seja derivada de uma descrição na língua Makonde, que significa “aquele que se dobra para cima”, em referência a postura contorcida de pessoas afetadas e sofrendo com a dor articular severa, sintomas de artrite associados a esta doença (Centers for Disease Control Prevention, 2006). O vírus da chikungunya causa uma infecção viral caracterizada pelo aparecimento súbito de febre de dois a quatro dias após a exposição ao mosquito Aedes aegypti.

Aedes aegypti
A doença foi descrita pela primeira vez por Marion Robinson e RCQ Lumsden (Lumsden, 1955) em 1955, após um surto que acometeu Makonde Plateau, ao longo da fronteira entre Moçambique e Tanganica (parte continental da Tanzânia) em 1952. De acordo com o relatório inicial de 1955 sobre a epidemiologia da doença, o termo “chikungunya” é derivado do verbo kungunyala. Pesquisadores posteriores ignoraram as referências à língua Makonde e assumiram o termo ter sido derivado de Swahili, uma língua franca da região. A atribuição errônea de Swahili foi repetida em várias fontes de impressão (Benjamin, 2008) e muitos grafias erradas do nome da doença também são de uso comum, como o chicungunha, na versão brasileirada.
Desde sua descoberta em Tanganica, na África, surtos de vírus chikungunya ocorreram ocasionalmente no Sul e Sudeste da Ásia e África, e agora espalharam-se pelo mundo.
Historicamente, o primeiro surto registrado desta doença pode ter sido em 1779 (Carey, 1971) de acordo com a evidência genética molecular que sugere que ele surgiu por volta do ano 1700 (Cherian
et al, 2009). O vírus é transmitido aos seres humanos por duas espécies de mosquito do gênero
Aedes: o tradicional
A. aegypti e o
A. albopictus (Lahariya & Pradhan, 2006; Staples & Fischer, 2014) onde os reservatórios do vírus incluiam macacos, aves, gado e roedores (Schwarz
et al, 2012). Em contrapartida, o único reservatório animal do vírus da dengue são os primatas (
World Health Organization). Desde 2004, surtos ocorreram tanto na Ásia, quanto Europa e nas Américas. Uma pesquisa feita pelo Instituto Pasteur na Paris mostrou que estirpes de vírus chikungunya que provocaram surtos de 2005/2006 ocorreu devido uma mutação que facilitou a transmissão pelo mosquito tigre-asiático tendo como vetor o
A. albopictus (Enserink, 2007). Outras espécies potencialmente capazes de transmitir o vírus chikungunya incluem
A. furcifer,
A. africanus e
A. luteocephalus (Burt
et al, 2012).
O chikungunya causa febre acompanhada de dores articulares durante semanas ou meses, e às vezes por anos (Powers & Logue, 2007; Sourisseau et al, 2007; Schilte et al, 2013). A taxa de mortalidade é um pouco menor que 1 pessoa por 1000 habitantes e afeta mais idosos e pessoas com algum problema médico crônico com complicações graves (Mavalankar et al, 2008). O vírus chikungunya, é biologicamente referido como CHIKV, um membro do gênero Alphavirus da família Togaviridae.
Em imunologia, alfavírus é uma classificação biológica feita com base na composição do genoma viral que foi descrita pela primeira vez por David Baltimore em 1971. Como todos os o outros vírus do grupo IV, ele tem um sentido positivo, ou seja, uma cadeia-única, uma fita de RNA. Há trinta alfavírus capazes de infectar vários vertebrados, tais como os seres humanos, roedores, peixes, aves e mamíferos de grande porte tais como cavalos. E claro, também invertebrados. A transmissão entre espécies e indivíduos ocorre principalmente através de mosquitos. Este vírus esta envolvido em estruturas moleculares com um diâmetro de 70 nm, tendem a ser de forma esférica (ou ligeiramente pleomorfo), com um cápsula proteica em torno do núcleo nucleocapsídeo medindo 40 nm (
Oxford dictionaries).
Por ser um RNA com um genoma de sentido positivo e sua cadeia, tem de cerca de 11.6kb. (Weaver
et al, 2012) é um membro do complexo de vírus da floresta de Semliki e está intimamente relacionado com o vírus
Ross River, vírus
O’nyong Nyong (Powers
et al, 2001). Uma vez que é transmitido por artrópodes, podem também ser referidos como um arbovírus (caracteristica que determina o grupo). Nos Estados Unidos, é classificado como um patógeno prioridade categoria C, (NIAID Category, 2014) e trabalho requer Nível de Biossegurança precauções III (Biosafety in Microbiological and Biomedical Laboratories, 2014). De acordo com a
CDC (Centers for Disease Control and Prevention – Centro de Controle e Prevenção de Doenças), agentes de categoria C são de 3ª maior prioridade pois incluem patógenos emergentes.
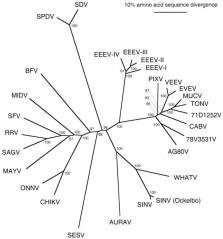
Árvore filogenética de espécies de alfavírus gerada a partir de sequências completas de poliproteína. Os números referem-se aos valores definidos para clados pelo nó.
Fonte:
Journal of Virology
Um modo menos comum de transmissão do chikungunya é a transmissão vertical; transmissão de mãe para filho durante a gravidez ou no momento do nascimento. A transmissão através de produtos sanguíneos infectados e através de doação de órgãos, também é teoricamente possível em épocas de surto, embora nenhum caso ainda tenha sido documentado (Burt et al, 2012).
O caso mais comum e que gera surtos é através do mosquito. A adaptação de mosquitos a mudanças climáticas do Norte de África há cerca de 5 mil anos o fez procurar ambientes onde os seres humanos armazenavam água (Morrison, 2014). Com o espalhamento do vírus chikungunya, que antes ocorria na região de Tanganica e do zika em uma floresta africana, associado a radiação do mosquito A. Aegypti pelo mundo nos últimos séculos é possível compreender porque vírus que eram apenas regionais passaram a causar mortes pelo mundo todo. Devemos lembrar que o surto de Ebola em 2014 também foi causado por esta via, começando na Nigéria, década de 70, ou mesmo a “gripe-suína” que começou na China.
Durante os períodos de epidemias de seres humanos são o reservatório do vírus. Como grandes quantidades de vírus estão presentes no sangue no início da infecção aguda, o vírus pode ser transmitido a partir de um ser humano com viremia para um mosquito que atua como vetor e re-transmite de volta ao ser humano (Morrison, 2014). Três sorotipos deste vírus têm sido descritos, cada um com um genótipo e características antigênicas diferentes; um do Oeste Africano, outro do Sudeste/Centro e Sul Africano e um Asiáticos (Powers et al, 2000).
Durante o processo de infecção, o vírus chikungunya é passado para os seres humanos quando uma picada de um mosquito infectado rompe a pele e introduz o vírus no corpo. O processo de infecção por chikungunya em seres humanos ainda é mal compreendido em seus detalhes moleculares apesar de surtos recentes; diferente da dengue que já é bem caracterizada. Em experimentos
in vitro, o vírus chikunguya é capaz de replicar em células epiteliais humanas e células endoteliais, fibroblastos primários, e os macrófagos derivados de monócitos. A replicação viral é altamente citopática (mudanças bioquímicas das células e alterações morfológicas), mas susceptíveis ao interferon (Sourisseau
et al, 2007). Interferon é uma proteína produzida pelos leucócitos e fibroblastos cuja função é interferir na replicação de vírus, bactérias e células de tumores, além de estimular a atividade de defesa de outras células. Existem
três tipos de interferon, classificados de acordo com o receptor celular e resposta que ativam.
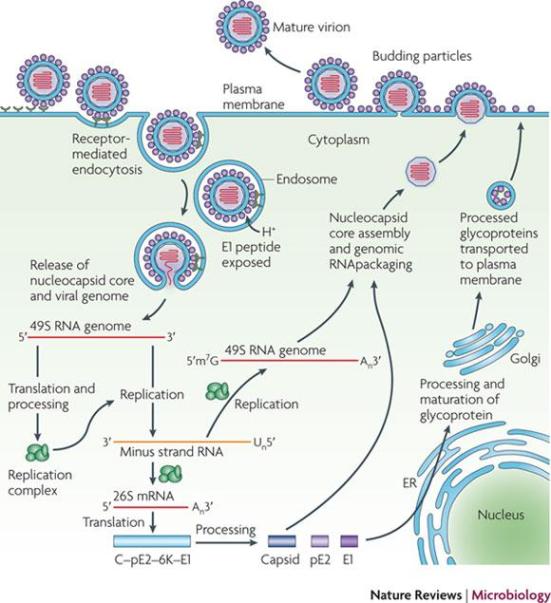
O ciclo de vida Alphavirus está representado na figura. O Alphavirus entrar nas células alvo por endocitose. Em meio ácido do endossoma desencadeia mudanças conformacionais no envelope viral peptídeo que expõem a E1, e medeia a fusão da membrana do vírus na célula-hospedeira. Isto permite a libertação citoplasmática do núcleo e a libertação dos genoma viral. Os dois precursores de proteínas não-estruturais (PTS), são convertidos a partir do RNAm viral, e a clivagem destes precursores gera-NSP1 NSP4. NSP1 está envolvida na síntese da cadeia negativa do RNA viral. O NSP2 exibe atividades como a RNA helicase, trifosfatase RNA e proteinase e está envolvido no desligamento da trascriçao na célula hospedeira, e NSP3 faz parte da replicase NSP4 e o RNA viral é polimerase. Estas proteínas montam-se e formam o complexo de replicação viral, que sintetiza um RNA de cadeia negativa intermediário. Isto serve como molde para a síntese de ambos RNAs sub-genômicos (26S) e genômicos (49S). O RNA sub-genômico dirige a expressão do precursor de poliproteina C-pE2-6K-E1 que é processada por uma protease serina autoproteolica. A cápside (C) é libertado, e as glicoproteínas PE2 e E1 são geradas por processamento adicional. As pE2 e E1 associadas ao Golgi são exportadas para a membrana plasmática, onde pE2 é clivada em E2 (que está envolvida na ligação ao receptor) e E3 (que medeia dobragem adequada de pE2 e sua posterior associação com E1). A montagem viral é promovida pela ligação do nucleocapsídeo viral para o RNA viral e o recrutamento das glicoproteínas do envelope associada à membrana.
Fonte:
Nature
In vivo, no estudos com células vivas, o vírus chikungunya parece replicar-se em fibroblastos, células progenitoras de músculo esquelético, e miofibras (Ozden et al, 2007).
A resposta do interferon tipo-1 parece desempenhar um papel importante na resposta do hospedeiro à infecção chikungunya. Após a infecção, fibroblastos do hospedeiro produzem o interferon-tipo1-α e interferon-tipo1-β (IFN-α e IFN-β). Em estudos com ratos expostos ao chikungunya, com deficiências no INF-1 leva ao aumento da mortalidade (Schilte et al, 2010). Os componentes específicos do chikungunya da via de interferon-tipo-1 envolvido na resposta do hospedeiro à infecção seja ainda desconhecidas (White et al, 2011).
Na fase aguda (duração menor que duas semanas) do chikungunya, o vírus está normalmente presente nas áreas onde os sintomas estão presentes; músculos esqueléticos especificamente e articulações. Na fase crônica, a persistência viral (a incapacidade do corpo para libertar-se totalmente do vírus), a falta de depuração do antigênio contribui para a dor articular. A resposta da inflamação durante a fase aguda e crônica da doença resulta em parte das interações entre o vírus com monócitos e macrófagos. Níveis elevados de citocinas e quimiocinas (proteínas de sinalização celular) específicas têm sido associados à doença aguda mais severa.
As citoquinas podem também contribuir para a versão crônica da chickungunya crônica, levando a uma elevação ligeira de granulócitos-macrófagos e de proteína C-reativa (CRP), sugerindo o início de uma inflamação crônica (Morrison, 2014).
O vírus CHIKV é composto por quatro proteínas não-estruturais e três proteínas estruturais (Weaver etal, 2015). As proteínas estruturais são o capsídeo e duas glicoproteínas do envelope viral: E1 e E2, que formam pontas heterodiméricas na superfície (vide primeira figura deste texto). A glicoproteina E2 se liga aos receptores celulares, de modo a entrar na célula hospedeira através de endocitose mediada pelo receptor. A glicoproteina E1 contém um peptídeo de fusão que, quando expostos à acidez do endossoma, em células eucarióticas, dissocia-se do E2 e inicia a fusão da membrana que permite a libertação dos nucleocapsídeos para o citoplasma, promovendo a infecção (Voss
et al, 2010). O vírus maduro contém 240 pontos heterodiméricos de E2/E1, que são liberados na superfície da célula infectada, e são expulsos por exocitose de infectar outras células (Weaver etal, 2015). O vírus da dengue passa pelo mesmo tipo de procedimento e foi retratado anteriormente
aqui.
Durante o surto de chukungunya de La Reunion em 2006, cerca de 50% pessoas com mais de 45 anos relataram dor múscular-esquelética a longo prazo (Gérardin et al, 2013). Cerca de 60% das pessoas relatam dor nas articulações durante três anos após a infecção inicial (Schilte et al, 2013). Um estudo de caso demonstrou que 59% das pessoas ainda sofriam de artralgia (dor nas articulações) dois anos após a infecção aguda (Larrieu et al, 2010). Em uma epidemia local de chikungunya na Itália, 66% das pessoas relataram dores musculares, nas articulações ou fraqueza um ano depois infecção aguda (Moro et al, 2012). Atualmente, a causa destes sintomas crônicos não é totalmente conhecida (Schilte et al, 2013).
A melhor estratégia para evitar ser infectado pelo vírus chikunguya é evitar a proliferação do mosquito vetor, e claro, não existe nenhuma vacina aprovada. O controle da população do mosquito vem da eliminação de locais onde a água fica parada, onde os mosquitos depositam os ovos e se desenvolve como larva; uso de inseticida, adição de cloro ou agua sanitária onde a eliminação da água parada não for possível (Weaver et al, 2015). Métodos de proteção contra o contato com mosquitos incluem o uso de repelentes de insetos com substâncias como DEET, icaridina, PMD (p-mentano-3,8 -diol, uma substância derivado da árvore do eucalipto limão), ou IR3535.
.
Aspectos epidemiológicos do chikungunya e sua presença no Brasil.
Historicamente, o chikungunya está amplamente distribuído no mundo. A doença causa cerca de 3 milhões de infecções por ano (Seppa, 2015). As epidemias no Oceano Índico, Ilhas do Pacífico e nas Américas continuam alterando a distribuição da doença (Poh et al, 2012). Na África, o chikungunya é espalhado por um ciclo silvestre em que o vírus se adapta dentre primatas não-humanos, mamíferos pequenos, e os mosquitos geram surtos em humanos (Powers et al, 2002). Os surtos foram normalmente ligados à precipitação. Nos últimos anos os surtos em centros urbanos, o vírus se espalhou pela circulação entre humanos e mosquitos (Burt et al, 2012) e as taxas globais de infecção por chikungunya se tornaram variáveis.
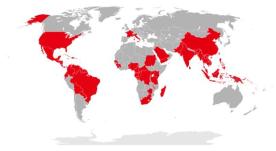
Vermelho demonstra países com a transmissão anterior ou atual local de CHIKV constatada pelo CDC a partir de julho de 2015.
Quando chikungunya foi identificado pela primeira vez em 1952, ele teve uma circulação de baixo nível na África Ocidental, com as taxas de infecção relacionadas às chuvas. Começando na década de 1960, surtos periódicos foram documentados na Ásia e África. No entanto, desde 2005, o chikungunya ressurgiu e causou grandes surtos na África, Ásia e Américas. Na Índia, por exemplo, o chikungunya re-apareceu depois de 32 anos de ausência de atividade viral (Lahariya & Pradhan, 2006). Os surtos ocorreram na Europa, Caribe e América do Sul, áreas em que a chikungunya não foi previamente transmitido. A transmissão local também ocorreu nos Estados Unidos e na Austrália, países em que o vírus era até então desconhecido (Burt et al, 2012). Em 2005, quando houve o surto na ilha La Reunion, em seguida, foi documentado uma estimativa de 266 mil casos em uma ilha com um população de aproximadamente 770 mil (Roth et al, 2014). No surto de 2006, a Índia relatou 1,25 milhões de casos suspeitos (Muniaraj, 2014). O chikungunya foi recentemente introduzido nas Américas, e desde 2013-14 e cerca de 1,118,763 casos suspeitos foram relatados, com 24.682 casos confirmados foram relatados na Organização Pan-Americana da Saúde (OPAS, 2015).
Uma análise do código genético do vírus Chikungunya sugere que o aumento da gravidade da situação em 2005 pode ter sido causado por uma alteração na sequência genética que alterou o segmento de E1 do vírus da ‘proteína de revestimento viral, criando uma variante chamada E1-A226V. Esta mutação permite potencialmente que o vírus se multiplique mais facilmente nas células de mosquito (Schuffenecker
et al, 2006). A alteração permite que o vírus a utilizar o mosquito tigre asiático (discutido previamente). A transmissão por
A. albopictus pode significar um aumento do risco de surtos em outras áreas onde o mosquito está presente. Esta, é uma espécie invasora que se espalhou pela Europa, Américas, Caribe, África e Oriente Médio.
Após a detecção do vírus zika no Brasil em abril de 2015 (
G1, 2015) acredita-se que casos de dengue e chikungunya poderiam ser de fato casos de vírus ou co-infecções.
No ano de 2015 foram notificados 20.661 casos suspeitos de febre de chikungunya; comparado com 2014 que somaram 3.657 casos. Ao todo, 7.823 foram confirmados em 2015, sendo 560 por critério laboratorial e 7.263 clínico-epidemiológico. O restante ainda está em investigação mas de acordo com os dados,18 estados registraram a circulação do vírus. No período, registraram-se três óbitos pela doença no Brasil, sendo dois na Bahia e um em Sergipe. Conforme as investigações, essas mortes ocorreram em pessoas com idade avançada (85, 83 e 75 anos) com histórico de doenças crônicas preexistentes.
As infecções por chikungunya (e dengue) têm os mesmos sintomas. As peculiaridades são que, enquanto a dengue tem evolução mais grave, a febre chikungunya é considerada mais leve, mas com dores mais intensas nas articulações (
Agencia Brasil, 2016).
Victor Rossetti
Palavras chave: NetNature, Rossetti, Chikungunya, CHIKV, Aedes aegypti, Vírus, Epidemiologia, África, Tanganica.
.
Referências
Benjamin M (2008). “Chikungunya is NOT a Swahili word, it is from the Makonde language!
Biosafety in Microbiological and Biomedical Laboratories (BMBL) Fifth Edition” (PDF). Retrieved 1 January 2014.
Burt, Felicity J; Rolph, Micheal S; Rulli, Nestor E; Mahalingam, Suresh; Heise, Mark T (2012). “Chikungunya: a re-emerging virus”. The Lancet 379 (9816): 662–671.
Carey DE (July 1971). “Chikungunya and dengue: a case of mistaken identity?”. J Hist Med Allied Sci 26 (3): 243–62.
Centers for Disease Control Prevention (CDC) (29 September 2006).
Cherian SS, Walimbe AM, Jadhav SM, Gandhe SS, Hundekar SL, Mishra AC, Arankalle VA (January 2009). “Evolutionary rates and timescale comparison of Chikungunya viruses inferred from the whole genome/E1 gene with special reference to the 2005-07 outbreak in the Indian subcontinent”. Infect. Genet. Evol. 9 (1): 16–23.
Enserink M (2007). “EPIDEMIOLOGY: Tropical Disease Follows Mosquitoes to Europe”. Science 317 (5844): 1485.
Gérardin P, Fianu A, Michault A, Mussard C, Boussaïd K, Rollot O, Grivard P, Kassab S, Bouquillard E, Borgherini G, Gaüzère BA, Malvy D, Bréart G, Favier F (9 January 2013). “Predictors of Chikungunya rheumatism: a prognostic survey ancillary to the TELECHIK cohort study.”. Arthritis Research & Therapy 15 (1): R9.
Lahariya C, Pradhan SK (December 2006). “Emergence of chikungunya virus in Indian subcontinent after 32 years: A review” (PDF). J Vector Borne Dis 43 (4): 151–60.
Larrieu S, Pouderoux N, Pistone T, Filleul L, Receveur MC, Sissoko D, Ezzedine K, Malvy D (Jan 2010). “Factors associated with persistence of arthralgia among Chikungunya virus-infected travellers: report of 42 French cases.”. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology 47 (1): 85–8
Lumsden WH (1955). “An epidemic of virus disease in Southern Province, Tanganyika Territory, in 1952–53. II. General description and epidemiology”. Trans. R. Soc. Trop. Med. Hyg. 49 (1): 33–57.
Mavalankar D, Shastri P, Bandyopadhyay T, Parmar J, Ramani KV (2008). “Increased Mortality Rate Associated with Chikungunya Epidemic, Ahmedabad, India”. Emerging Infectious Diseases 14 (3): 412–5.
Moro ML, Grilli E, Corvetta A, Silvi G, Angelini R, Mascella F, Miserocchi F, Sambo P, Finarelli AC, Sambri V, Gagliotti C, Massimiliani E, Mattivi A, Pierro AM, Macini P (August 2012). “Long-term chikungunya infection clinical manifestations after an outbreak in Italy: a prognostic cohort study.”. The Journal of infection 65 (2): 165–72.
Morrison, T. E. (2014). “Reemergence of Chikungunya Virus”. Journal of Virology 88 (20): 11644–11647.
Muniaraj M (2014). “Fading chikungunya fever from India: beginning of the end of another episode?”. Indian J. Med. Res. 139 (3): 468–70.
NIAID Category A, B, and C Priority Pathogens”. Retrieved 1 January 2014.
Ozden S, Huerre M, Riviere JP, Coffey LL, Afonso PV, Mouly V, de Monredon J, Roger JC, El Amrani M, Yvin JL, Jaffar MC, Frenkiel MP, Sourisseau M, Schwartz O, Butler-Browne G, Desprès P, Gessain A, Ceccaldi PE (13 June 2007). “Human muscle satellite cells as targets of Chikungunya virus infection.”. PLoS ONE 2 (6): e527.
Pan-American Health Organization (PAHO). 2015.
Poh, Lisa Ng Fong; Sam, I-Ching; Loong, Shih-Keng; Michael, Jasmine Chandramathi; Chua, Chong-Long; Wan Sulaiman, Wan Yusoff; Vythilingam, Indra; Chan, Shie-Yien; Chiam, Chun-Wei; Yeong, Yze-Shiuan; AbuBakar, Sazaly; Chan, Yoke-Fun (2012). “Genotypic and Phenotypic Characterization of Chikungunya Virus of Different Genotypes from Malaysia”. PLoS ONE 7 (11): e50476.
Powers AM, Weaver SC, Stinchcomb DT, Osorio JE (April 2011). “Probing the attenuation and protective efficacy of a candidate chikungunya virus vaccine in mice with compromised interferon (IFN) signaling”. Vaccine 29 (16): 3067–73.
Powers AM, Brault AC, Tesh RB, Weaver SC (February 2000). “Re-emergence of Chikungunya and O’nyong-nyong viruses: evidence for distinct geographical lineages and distant evolutionary relationships”. J. Gen. Virol. 81 (Pt 2): 471–9.
Powers AM, Brault AC, Shirako Y, Strauss EG, Kang W, Strauss JH, Weaver SC (November 2001). “Evolutionary relationships and systematics of the alphaviruses”. Journal of Virology 75 (21): 10118–31.
Powers AM, Logue CH (September 2007). “Changing patterns of chikungunya virus: re-emergence of a zoonotic arbovirus”. J. Gen. Virol. 88 (Pt 9): 2363–77.
Roth, Adam; Hoy, Damian; Horwood, Paul F.; Ropa, Berry; Hancock, Thane; Guillaumot, Laurent; Rickart, Keith; Frison, Pascal; Pavlin, Boris; Souares, Yvan (2014). “Preparedness for Threat of Chikungunya in the Pacific”. Emerging Infectious Diseases 20 (8).
Schwarz NG, Girmann M, Randriamampionona N, Bialonski A, Maus D, Krefis AC, Njarasoa C, Rajanalison JF, Ramandrisoa HD, Randriarison ML, May J, Schmidt-Chanasit J, Rakotozandrindrainy R (November 2012).
Schilte C, Staikowsky F, Staikovsky F, Couderc T, Madec Y, Carpentier F, Kassab S, Albert ML, Lecuit M, Michault A (2013). “Chikungunya virus-associated long-term arthralgia: a 36-month prospective longitudinal study.”. PLoS neglected tropical diseases 7 (3): e2137.
Schilte C, Couderc T, Chretien F, Sourisseau M, Gangneux N, Guivel-Benhassine F, Kraxner A, Tschopp J, Higgs S, Michault A, Arenzana-Seisdedos F, Colonna M, Peduto L, Schwartz O, Lecuit M, Albert ML (February 2010). “Type I IFN controls chikungunya virus via its action on nonhematopoietic cells”. J. Exp. Med. 207 (2): 429–42.
Schuffenecker I, Iteman I, Michault A; et al. (July 2006). “Genome microevolution of chikungunya viruses causing the Indian Ocean outbreak”. PLoS Med. 3 (7): e263.
Seppa, Nathan (2 Jun 2015). “Chikungunya is on the move”. Science News
Sourisseau M, Schilte C, Casartelli N, Trouillet C, Guivel-Benhassine F, Rudnicka D, Sol-Foulon N, Le Roux K, Prevost MC, Fsihi H, Frenkiel MP, Blanchet F, Afonso PV, Ceccaldi PE, Ozden S, Gessain A, Schuffenecker I, Verhasselt B, Zamborlini A, Saïb A, Rey FA, Arenzana-Seisdedos F, Desprès P, Michault A, Albert ML, Schwartz O (June 2007). “Characterization of reemerging chikungunya virus”. PLoS Pathog. 3 (6): e89.
Staples JE, Fischer M (2014). “Chikungunya virus in the Americas–what a vectorborne pathogen can do”. N. Engl. J. Med. 371 (10): 887–9.
Voss, JE; Vaney, MC; Duquerroy, S; Vonrhein, C; Girard-Blanc, C; Crublet, E; Thompson, A; Bricogne, G; Rey, FA (2 December 2010). “Glycoprotein organization of Chikungunya virus particles revealed by X-ray crystallography.”. Nature 468 (7324): 709–12.
Weaver, Scott C; Osorio, Jorge E; Livengood, Jill A; Chen, Rubing; Stinchcomb, Dan T (2012). “Chikungunya virus and prospects for a vaccine”. Expert Review of Vaccines 11 (9): 1087–1101.
Weaver, Scott C.; Lecuit, Marc (2015). “Chikungunya Virus and the Global Spread of a Mosquito-Borne Disease”. New England Journal of Medicine 372 (13): 1231–1239.
White LK, Sali T, Alvarado D, Gatti E, Pierre P, Streblow D, Defilippis VR (January 2011). “Chikungunya virus induces IPS-1-dependent innate immune activation and protein kinase R-independent translational shutoff”. J. Virol. 85 (1): 606–20.